- «Чжуншэнь» — 20 лет в сфере ВЭД.
- Телефон: +86 139 1787 2118
Южная КореяМедтехникаПроцедура доступа к рынку относительно сложна и включает в себя несколько этапов и участие нескольких департаментов. В данной статье будет кратко представлена процедура сертификации и регистрации медицинского оборудования для экспорта в Южную Корею.
руководящий орган
Корейское Управление по контролю за продуктами питания и лекарствами (MFDS) является ведущим органом по медицинским приборам и устройствам в Южной Корее, отвечающим за продукцию питания, лекарства, медицинские приборы и устройства, а такжеКосметикабезопасности, развитию пищевой и фармацевтической промышленности, а также продвижению общественного здоровья.
Классификация медицинского оборудования
Корея классифицирует медицинские изделия на четыре категории, а именно I, II, III, IV классы, и этот метод классификации очень похож на метод классификации медицинских изделий в Европейском союзе. Каждая категория изделий имеет разные пути доступа к рынку, и на основе классификации медицинских изделий по риску审批流程 и сроки также различаются.
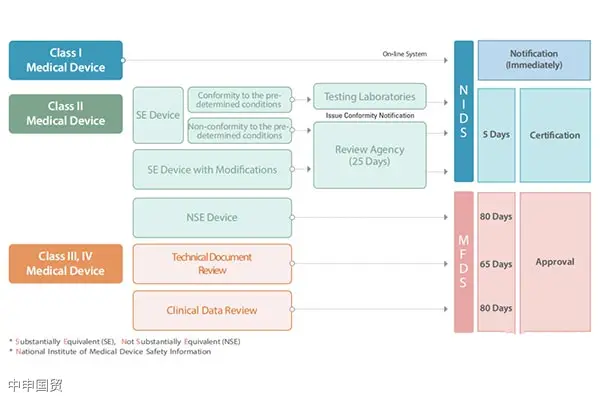
Тестирование продуктов и клинические испытания
Образцы продукции, подлежащие регистрации, могут быть напрямую отправлены в корейский лабораторий для проведения испытаний или испытаны в национальных лабораториях, обладающих соответствующей корейской аттестацией, с предоставлением соответствующего тестового отчета. MFDS определяет ряд тестовых лабораторий и стационарных больниц для клинических испытаний.
Систематическая оценка
Производители медицинского оборудования классов II, III, IV, экспортирующего в Республику Корея, должны соответствовать требованиям KGMP (Korean Good Manufacturing Practice), которые аналогичны требованиям ISO 13485. Сертификат KGMP выдается импортеру, а не производителю, и обновляется каждые 3 года.
Веб-сайт для подачи заявок на сертификаты косметики Южной Кореи:https://kcia.or.kr/cert/main/
Процедура регистрации медицинского оборудования в Южной Корее
Ввоз медицинского оборудования из Южной Кореи включает в себя следующие шаги: выбор представителя в Южной Корее, регистрация продукции, подготовка документов, испытание продукции, клинические испытания, получение сертификата регистрации продукции, подготовка документов KGMP, получение доступа в больницы.
Регуляция продукта при выходе на рынок и после выхода на рынок
После выдачи удостоверения о регистрации продукции и сертификата KGMP для медицинского оборудования не для бытового использования необходимо также пройти процедуру допуска в больницы, войти в систему медицинского страхования больниц и получить номер медицинского страхования больницы. После этого продукция может официально продаваться на корейском рынке. После запуска продукта на рынок MFDS имеет право отслеживать некоторые назначенные высокорисковые медицинские изделия. Продукцию, вызвавшую нежелательные реакции на корейском рынке, следует своевременно отзывать.
Наконец, условия для въезда иностранных продуктов на корейский рынок заключаются в следующем: необходимо подготовить очень подробную техническую документацию по продукту и материалы, необходимые для подачи заявки на корейский KGMP; система компании должна соответствовать требованиям ISO 13485; продукт должен соответствовать требованиям стандартов. Это и есть система регулирования доступа медицинского оборудования в Южную Корею, надеюсь, что это поможет медицинскому оборудованиюИмпорт и экспортпоможет предприятиям.
Рекомендуем также:
© 2025. All Rights Reserved.沪ICP备2023007705号-2 Номер разрешения на безопасность в сети Шанхая: 31011502009912.
Номер разрешения на безопасность в сети Шанхая: 31011502009912.